神経膠腫(グリオーマ)
神経膠腫(グリオーマ)はどんな病気ですか?
脳は神経細胞、神経線維、神経膠細胞(グリア)などの細胞で構成されます。神経膠細胞は神経に栄養を与えたり、神経の活動を支えたりしています。この神経膠細胞から発生する腫瘍を大きくまとめて神経膠腫(グリオーマ)と呼びます。神経膠腫には、とても多くの腫瘍タイプや悪性度があります(表1)。病理診断医でも診断に悩むこともあります。 神経膠腫には他臓器の腫瘍のように悪性度を表現するステージ分類がありません。そこで、脳腫瘍では悪性度をグレードで分類します。グレード1に分類される毛様細胞性星状細胞腫などは手術で全摘出されれば根治が得られることもありますので良性に近いものと考えます。グレード4が最も悪い腫瘍タイプです。
このタイプの脳腫瘍は、一人の脳腫瘍の中にも、異なった遺伝子異常を持つ腫瘍細胞が混ざっていることが明らかとなってきました。つまり、同じ病名でも抗がん剤の効果、放射線治療の効果、再発までの期間、生存期間が異なります。さまざまな腫瘍細胞が混ざっていることで、腫瘍の一部分だけの生検では診断が難しいこともあります。
| 神経膠腫の大分類 | 神経膠腫の細分類 | グレード(悪性度) |
| 星状細胞系腫瘍 | 毛様細胞性星状細胞腫 | 1 |
| 上衣下巨細胞性星状細胞腫 | 1 | |
| 多形黄色星状細胞腫 | 2 | |
| びまん性星状細胞腫 | 2 | |
| 退形成性星状細胞腫 | 3 | |
| 膠芽腫 | 4 | |
| 稀突起膠細胞系腫瘍 | 稀突起神経膠腫 | 2 |
| 退形成性稀突起神経膠腫 | 3 | |
| 上衣細胞系腫瘍 | 上衣腫 | 2 |
| 退形成性上衣腫 | 3 | |
| 脈絡叢系腫瘍 | 脈絡叢乳頭腫 | 1 |
| 脈絡叢癌 | 3 |
表1. グリオーマの分類
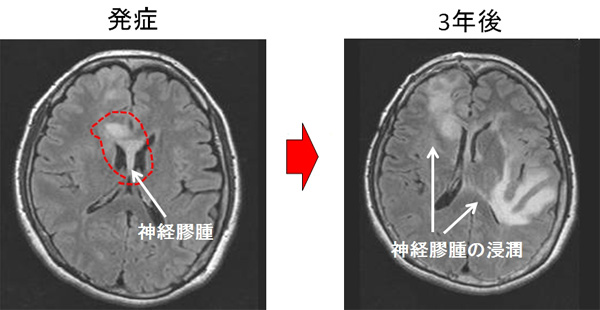
図1. 神経膠腫は脳実質に浸潤する
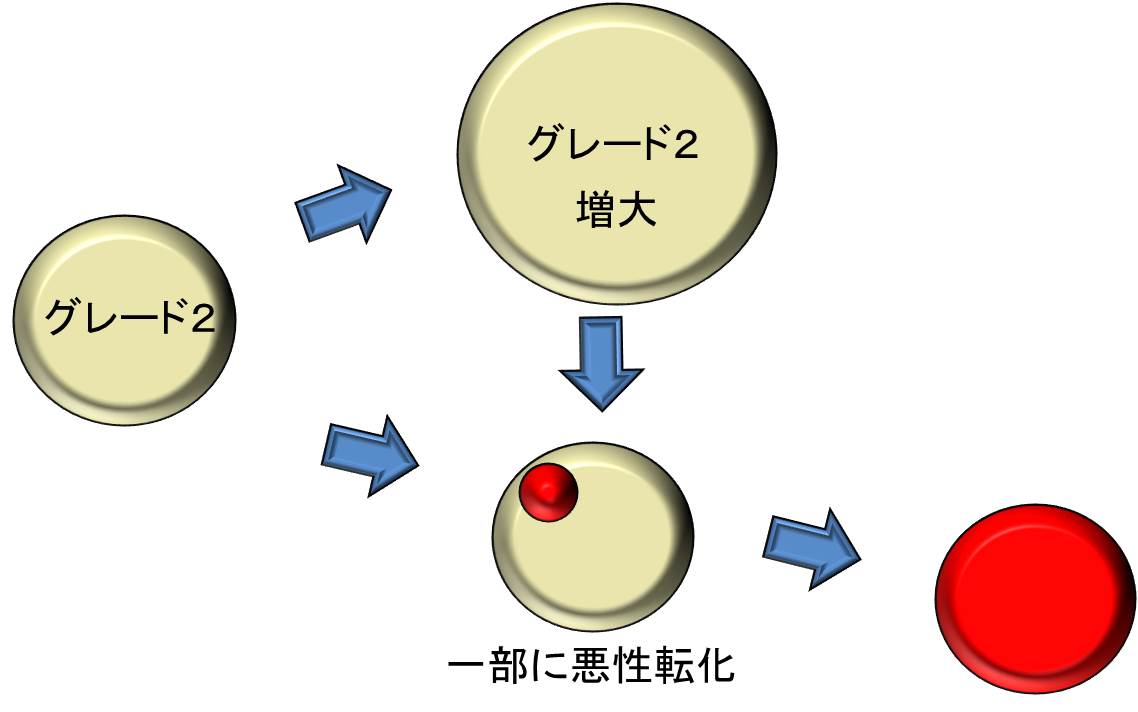 図2. 低悪性度神経膠腫の経過
図2. 低悪性度神経膠腫の経過
神経膠腫の一般的な治療法
グレード1に分類される神経膠腫は手術的な全摘出で根治に至ることが多いですが、残存があってもなくても経過を長く見る必要はあります。グレード3やグレード4と診断された神経膠腫の治療は、手術に加えて放射線治療や化学療法を用いた集学的な治療が必要となります。
神経膠腫の治療法には下記のような選択枝があります。
- 手術的摘出のみ
- 手術的摘出と化学療法(抗がん剤等)併用放射線療法
- 放射線治療のみ
- 放射線治療と化学療法(抗がん剤等)
- 化学療法(抗がん剤等)のみ
- その他に民間療法、免疫療法など
- 経過観察
神経膠腫には周囲の正常脳へ浸み込む性格(浸潤能)があり、正常神経細胞と共存していることもよくあります。神経膠腫の生命予後は、2000年の脳腫瘍全国集計で5年生存率が退形成性星状細胞腫で約30%、膠芽腫で約7%と報告されています。こうした治療成績は最新のさまざまな治療成績を反映しているものではありませんが、さまざまな治療法を用いてしっかりとした治療をする必要があります。
京大病院で行っている神経膠腫に対する先進的な治療
神経膠腫の手術では大切な脳機能を温存することが大切
神経膠腫の手術では摘出率が生命予後に関わります。しかし、脳は他臓器と異なり大事な部分がほとんどで簡単には全部摘出することはできません。単に腫瘍を摘出するだけでなく、京大病院では安全に摘出率を向上させるために覚醒下手術、高磁場MRIによる神経線維イメージング、術中ナビゲーション、脳機能マッピング、術中3テスラMRI撮影などの最新技術を用いています(図3)。これらの先進的な技術は手術の合併症を軽減する手術を可能としています。
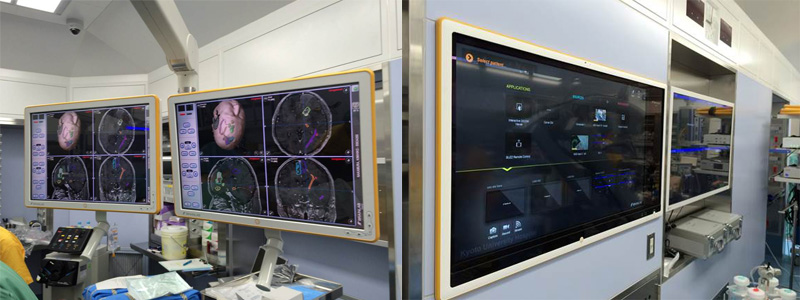
図3. ナビ・画像統合システム
ナビゲーションシステム:Curve CM(Brainlab)
画像統合システム:Buzz(Brainlab)
iPlan NET(ネットワークプランニング)
覚醒下手術
開頭術は全身麻酔で行います。全身麻酔では普段の生活に必要な神経機能をどんなにがんばっても精確に評価することができません。覚醒下手術は、手術中に患者さんを麻酔から覚まして神経機能を評価します。これにより、より正確な神経機能を評価した手術が可能となります。京都大学ではすでに200件以上の覚醒下手術を経験しています。手術中に覚醒することで大きな問題は生じることはありません。患者さんに満足をされる手術を行えています。
術中3テスラMRI撮影
MRIは、コントラスト分解能が高く、様々な撮像法が可能です。そこで、手術中にMRIでリアルタイムに術中診断を行うことは、手術精度の向上、合併症の回避に非常に有用です。国内では、すでに低磁場MRIを設置した施設で術中MRI撮像を用いた手術が実施されています。最近、海外の施設では、高磁場3テスラMRIを手術室に設置し、精度の向上だけでなく、高磁場で可能となるハイレベルな手術に応用されていますが、未だ国内では高磁場によるリスクもあり、設置する施設はありませんでした。しかし、高磁場3テスラMRIは、診断画像や脳機能画像を撮像するスタンダードな機器となっており、手術支援として3テスラMRIの設置が望まれていました。本手術システムの特徴は、高磁場3テスラMRI装置を手術エリアに設置し、術前・術中・術後のMRI撮影を迅速に行い、正確な手術の支援ができることです。連動する最新のナビゲーションは、術中のMRI画像を3次元構成し、リアルタイムに標的臓器を立体的に把握することが可能です。さらに、高磁場で可能となる脳機能画像(脳機能マッピング)・MRスペクトロスコピー(生体内分子解析)・トラクトグラフィ(神経線維画像)といった最新の撮像法を用いた手術を行っています。
図4. 3テスラ術中MRIシステム
化学療法
京都大学では初発神経膠腫だけでなく、再発性悪性神経膠腫に対しても積極的治療を行っています。患者さんの希望に応じて可能な限り積極的な治療を提供しています。
| 1. テモゾロミド (テモダール) |
悪性グリオーマの初期治療で用いています。世界的な標準治療と考えられています。 |
|---|---|
| 2. 低用量ICE治療 | 悪性グリオーマ再発では、低用量ICE(イホスファミド、カルボプラチン、エトポシド)を用いた化学療法が再発性悪性神経膠腫に有効であり、多くの患者さんで施行しています。 |
| 3. ベバシズマブ (アバスチン) |
米国では悪性グリオーマ再発で使用されています。日本では未だ認められておりませんが、悪性グリオーマ再発でICE無効の患者さんに使用することがあり、高い効果を示す患者さんもおられます。 |
| 4. イリノテカン (CPT-11) |
米国では悪性グリオーマ再発に対してアバスチンと併用されることが多い薬剤です。 |
| 5. VAC-feron (バックフェロン) |
カルボプラチン、ACNU、ビンクリスチン、インターフェロン・ベータを用いたグリオーマに対する化学療法です。膠芽腫に対する治療として作成したレジメです。用量を減量してグレード2神経膠腫の治療に用いています。 |
放射線治療
グレード3、グレード4の神経膠腫では内腹化学療法のテモダールを併用した放射線治療を実施します。病変に応じては最先端機器のトゥルービーム(TrueBeam)、ラピッドアークを用いた強度変調放射線治療(IMRT)を行うこともあります。IMRTは複雑な進行を示す神経膠腫の患者さんには安全性も高く、効果的な可能性が示唆されています。 切除困難な悪性グリオーマ再発に関してはトゥルービームを用いた特殊な定位的放射線治療を行って再発病変の進行を食い止めるように治療しています。
グレード2神経膠腫の治療方針
グリオーマの治療方針は病理組織診断に応じて行います。グレード2の病変は様子観察、積極的な治療をすると意見が分かれる病態でもあります。京大病院では、グレード2の神経膠腫を疑う場合には、可能な限り全摘出を目指した手術を行っています。全摘出され、病理でグレード2と診断された神経膠腫は画像経過観察を行っています。残存病変が認められた場合には、放射線治療、化学療法をお勧めしています。化学療法は京大病院で開発したVAC-feron(カルボプラチン、ACNU、ビンクリスチン、インターフェロン・ベータ)を用いています。
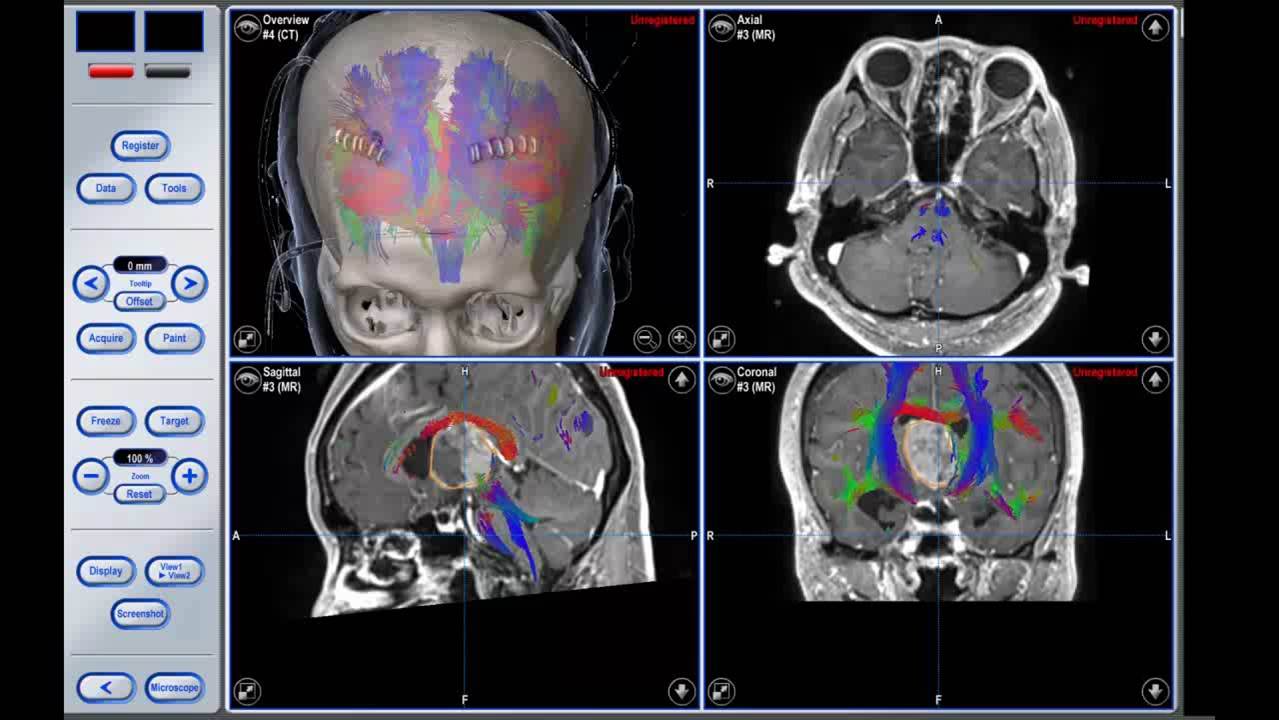
図5. 3テスラ術中MRIシステム
神経線維・脳機能を温存した腫瘍摘出





